TITRASI ASAM BASA (PART 2), ASAM LEMAH DITITRASI BASA KUAT YouTube
Daftar Asam Basa Kuat Dan Lemah
Amonia adalah senyawa kimia dengan rumus N H 3.Biasanya senyawa ini didapati berupa gas dengan bau tajam yang khas (disebut bau amonia).Walaupun amonia memiliki sumbangan penting bagi keberadaan nutrisi di bumi, amonia sendiri adalah senyawa kaustik dan dapat merusak kesehatan. Administrasi Keselamatan dan Kesehatan Pekerjaan Amerika Serikat memberikan batas 15 menit bagi kontak dengan amonia.

Tabel Asam Lemah dan Basa Lemah
Bahan Bahan Kimia Untuk Membuat Tinta Tak Tampak. Beberapa Contoh Basa Lemah Dan Kegunaannya Dalam kimia, basa dapat didefinisikan sebagai zat yang berdisosiasi dalam larutan berair untuk membentuk ion Hidroksida (OH−). Basa lemah adalah basa yang tidak sepenuhnya terdisosiasi menjadi ion penyusunnya ketika dilarutkan dalam larutan.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Dapatkan pemahaman yang lebih dalam tentang tabel asam basa kuat dan lemah dalam kimia! Temukan perbedaan dan karakteristik masing-masing asam dan basa yang membuat mereka menjadi kuat atau lemah. Menyajikan informasi yang bermanfaat untuk pengajar dan siswa kimia. Nikmati pembahasan lengkap dengan contoh-contoh yang menggugah rasa ingin tahu Anda di artikel ini.
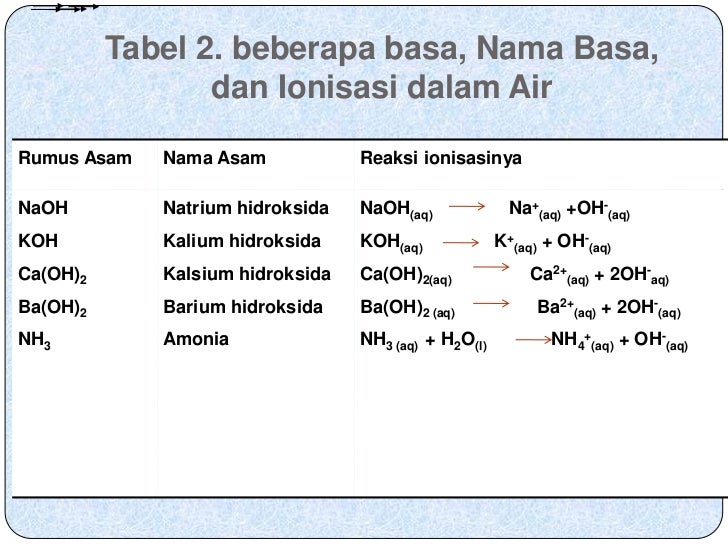
Contoh Asam Basa Kuat Dan Lemah Serta Reaksi Ionisasinya Berbagai Contoh
Asam Lemah. Dalam klasifikasi larutan asam basa, asam lemah adalah asam yang hanya sebagian kecil molekulnya ionisasi menjadi ion hidrogen (H+) dalam larutan. Dengan demikian, asam lemah memiliki konsentrasi ion hidrogen (H+) yang relatif rendah dalam larutan. Contoh asam lemah antara lain asam asetat (CH3COOH) dan asam format (HCOOH).

Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah
Asam kuat. Asam kuat terdisosiasi sempurna dalam air, membentuk H + dan anion. Ada enam asam kuat. Yang lain dianggap asam lemah. Anda harus memasukkan asam kuat ke memori: Jika asam 100 persen terdisosiasi dalam larutan 1,0 M atau kurang, itu disebut kuat.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 21
Asam dan basa konjugasi serta basa dan asam konjugasi dikenal sebagai pasangan konjugasi. Saat mencari konjugasi asam atau basa, perlu dilihat reaktan suatu persamaan kimia. Dalam kasus ini, reaktannya adalah asam dan basa. Untuk mengidentifikasi asam konjugasi, cari pasangan senyawa yang terkait.

TITRASI ASAM BASA (PART 2), ASAM LEMAH DITITRASI BASA KUAT YouTube
Berikut daftar asam kuat: Asam klorida (HCl) Asam nitrat (HNO3) Asam sulfat (H2SO4) Asam klorat (HClO3) Asam perklorat (HClO4) Asam bromida (HBr) Asam hidrogen iodida (HI) Baca Juga: 25 Contoh Soal Asam Basa dan Kunci Jawaban, Pilihan Ganda dan Essay.
Daftar Asam Basa Kuat Dan Lemah
Buku Interaksi Alam Basa Dalam Kehidupan menulis, menurut sumber asalnya, asam dibedakan menjadi 2 yakni asam organik dan asam anorganik. - Asam organik Asam organik merupakan asam yang banyak terdapat pada bahan makanan yang disebut asam karboksilat, dengan kandungan ikatan C - H atau C - O. Asam ini juga kerap dipakai untuk campuran bahan kosmetik.

35+ Contoh Soal Asam Basa Lemah Rochelle Proctor
July 19, 2023 by Tim redaksi. NH3 (Amonia) merupakan basa lemah. Ia tidak sepenuhnya terdisosiasi menjadi ion hidroksida (OH-) dalam air. Sebaliknya, ia hanya terionisasi sebagian, sehingga menghasilkan konsentrasi ion hidroksida yang lebih rendah dan pH yang lebih basa dibandingkan dengan basa kuat seperti KOH. Ya, itu hanya jawaban sederhana.
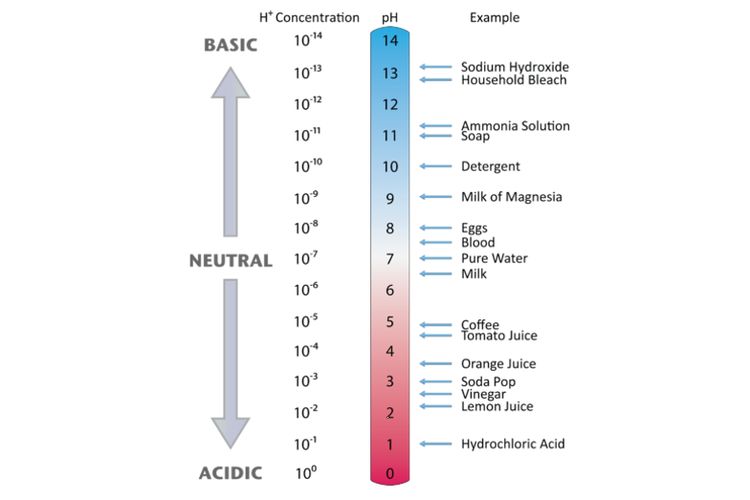
Daftar Nama AsamBasa Kuat dan AsamBasa Lemah
Contoh basa lemah adalah amonia. Ia tidak mengandung ion hidroksida, tetapi bereaksi dengan air untuk menghasilkan ion amonium dan ion hidroksida. [4] Posisi keseimbangan bervariasi dari satu basa ke basa lain ketika basa lemah bereaksi dengan air. Semakin jauh ke kiri itu, semakin lemah basanya.

Daftar Asam Basa Kuat dan Lemah
Pengertian Basa Kuat dan Basa Lemah Beserta Contohnya Lengkap. Materi basa kuat dan basa lemah sebenarnya sudah banyak di bahas pada buku pelajaran di sekolah. Materi ini juga sering muncul di berbagai soal ujian misalnya UTS, UAS, dan ujian nasional. maka dari itu mempelajari materi basa kuat dan basa lemah sangatlah penting.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah. Skala pH yang menunjukan suatu larutan bersifat asam atau basa (lumenlearning.com) KOMPAS.com - Asam merupakan zat yang menghasilkan ion hidrogen (H+) dalam larutan. Sementara basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam larutan. Asam dan basa dapat bereaksi menghasilkan air.

Teori Asam Basa
Jakarta - . Asam adalah adalah zat yang dapat menghasilkan ion hidrogen (H+) ketika dilarutkan ke dalam air. Kata asam (acid) berasal dari bahasa Latin acetum yang berarti cuka.Basa adalah zat yang dapat menghasilkan ion hidroksida (OH-) ketika dilarutkan ke dalam air. Kata basa (alkali) berasal dari bahasa Arab yang berarti 'abu', dikutip dari buku Asam, Basa, dan Garam karya Ratna Rima Melati.
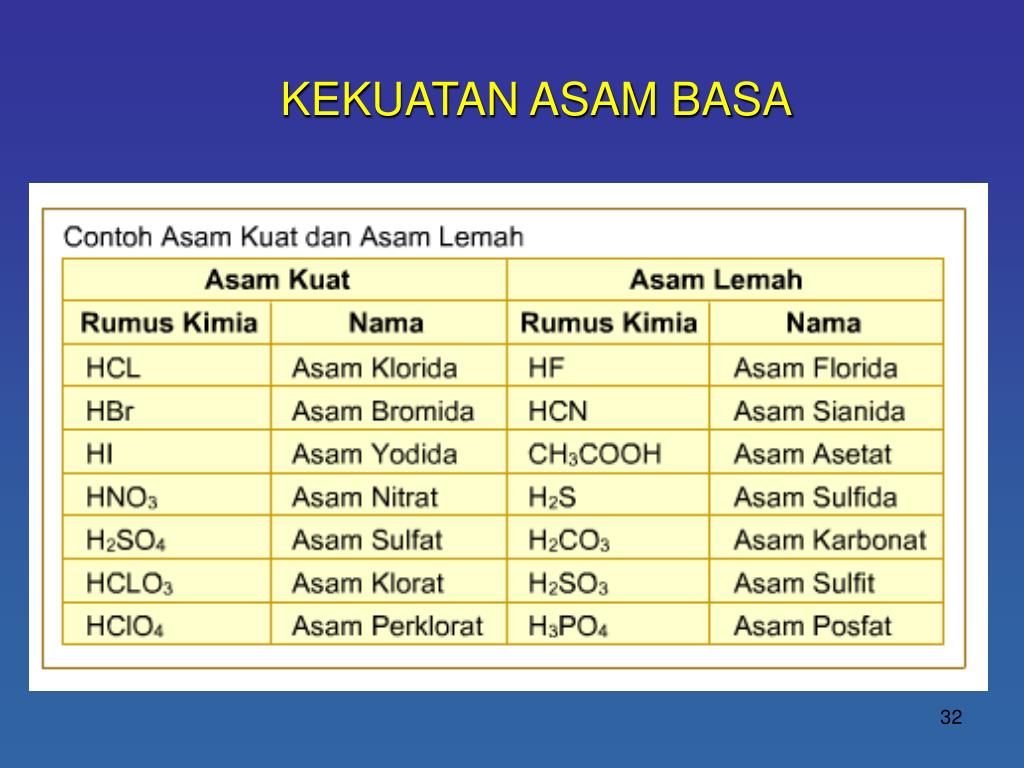
Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Berbagai Contoh
Sedangkan basa lemah adalah basa yang memiliki kemampuan yang lebih rendah dalam memberikan kelarutan dalam larutan air dan bereaksi dengan air sebagian. Basa lemah juga memiliki konduktivitas listrik yang lebih rendah dibandingkan basa kuat. Contoh basa lemah yang sering kita temui adalah amonia (NH3) dan hidrogen sulfida (H2S).

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
NH4OH adalah rumus kimia untuk senyawa amonia hidroksida. NH4OH merupakan senyawa amfoter, yang dapat berperilaku sebagai basa atau asam tergantung pada keadaan yang diberikan. Pada konsentrasi rendah, NH4OH cenderung lebih bersifat sebagai basa lemah, sedangkan pada konsentrasi tinggi, NH4OH dapat bertindak sebagai basa kuat.

Mg Oh 2 Basa Kuat Atau Lemah cara bertanya yang baik kepada guru
Amonia Sebagai Senyawa Basa. Sifat basa dari amonia membuat senyawa ini dapat bereaksi dengan asam untuk membentuk garam. Misalnya, ketika amonia bereaksi dengan asam klorida (HCl), senyawa amonium klorida (NH4Cl) terbentuk. Reaksi ini bersifat eksotermik, yang berarti bahwa reaksi ini melepaskan panas.