Pengertian Larutan Buffer, Prinsip, Sifat, Jenis dan Contoh

PPT ASAMBASAGARAM pH buffer PowerPoint Presentation, free download ID4658040
Pengertiannya, larutan penyangga (buffer) adalah larutan yang berfungsi untuk menstabilkan pH ketika sedang terjadi penambahan asam, basa, atau garam. Penyangga di sini merupakan sesuatu yang menyangga tingkat keasaman dalam sebuah larutan, sehingga tidak terjadi perubahan nilai ketika mendapat tambahan larutan asam atau basa meski sedikit saja.

Pengertian Larutan Buffer, Prinsip, Sifat, Jenis dan Contoh
Contoh: larutan penyangga yang mengandung CH 3 COOH dan CH 3 COO − Dalam larutan tersebut, terdapat kesetimbangan kimia: CH 3 COOH (aq) ⇌ CH 3 COO − (aq) + H + (aq) Pada penambahan asam (H + ), kesetimbangan akan bergeser ke arah kiri, sehingga reaksi mengarah pada pembentukan CH 3 COOH.

Mengenal buffer dalam sel (Pasangan asambasa konjugasi H2PO4 dan HPO42) YouTube
Fungsi larutan penyangga atau buffer dalam kehidupan sehari-hari antara lain: Mengontrol pH pada Sampo Siapa nih yang punya kebiasaan tiap hari harus keramas? Gue adalah salah satunya sih. Nah, ternyata larutan penyangga juga ada dalam sampolho. Penggunaan larutan penyangga pada shampo diperlukan untuk menjaga pH sampo.

Menghitung pH buffer setelah penambahan Asam dan Basa YouTube
1. Pengertian Larutan Penyangga Suatu larutan yang dapat menahan perubahan p H yang besar ketika ion-ion hidrogen atau hidroksida ditambahkan, atau ketika larutan itu diencerkan, disebut larutan buffer (penyangga). Secara umum larutan penyangga mengandung asam basa konjugat.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download ID6420439
Contoh: Campuran dari larutan CH 3 COOH (asam lemah) dan larutan CH 3 COONa (basa konjugasi) membentuk larutan buffer asam, dengan reaksi: CH 3 COOH + NaOH → CH 3 COONa + H 2 O . Campuran basa lemah dengan garamnya. Contoh: Campuran dari larutan NH 4 OH (basa lemah) dan larutan NH 4 CL (asam konjugasi) membentuk larutan buffer basa, dengan reaksi:

PPT Keseimbangan Asam Basa PowerPoint Presentation ID4714819
Larutan penyangga disebut juga " buffer " atau "penahan". Dalam kehidupan sehari-hari, terdapat berbagai reaksi kimia yang merupakan reaksi asam basa. Misalnya, reaksi beberapa enzim pencernaan dalam sistem biologis. Enzim pepsin yang berfungsi memecah protein dalam lambung hanya dapat bekerja optimal dalam suasana asam, yakni pada sekitar pH 2.

PPT ASAMBASAGARAM pH buffer PowerPoint Presentation, free download ID4658040
Larutan penyangga asam berasal dari asam lemah dan basa konjugasinya. Di mana basa konjugasi disediakan oleh garam. Fungsi dari larutan penyangga asam ini adalah untuk mempertahankan pH pada posisi asam (pH < 7). Contoh larutan penyangga asam ini yaitu kombinasi antara CH3COOH dan CH3COONa. Di dalam kombinasi tersebut, terkandung basa konjugasi.
Cara Menghitung pH Larutan Asam, Basa, Garam Beserta Contoh Soal dan Pembahasan Asymmetrical Life
Soal No. 1 Soal No. 2 Soal No. 3 Soal No. 4 Soal No. 5 Untuk meningkatkan pemahamanmu mengenai larutan penyangga, perhatikan 10 contoh soal larutan penyangga (buffer) berikut ini. Contoh Soal Larutan Penyangga Nomor 1-5 Soal No. 1 Larutan penyangga digunakan untuk mempertahankan pH suatu larutan. Apa yang yang dimaksud dengan larutan penyangga?
√ Larutan Penyangga / Buffer Pengertian, Rumus, dan Contoh Soal
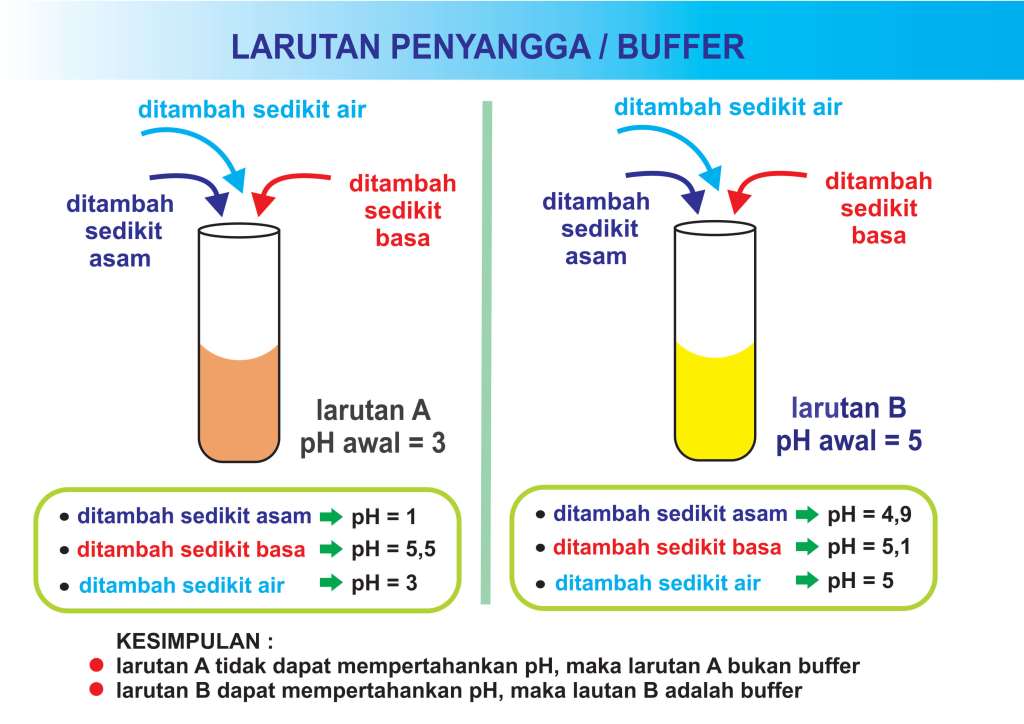
Sebagai contoh penambahan asam kuat ke dalam larutan buffer akan menurunkan sedikit pH larutan. Sedangkan penambahan asam kuat dengan jumlah dan konsentrasi yang sama ke dalam air tanpa buffer akan menurunkan pH larutan dalam jumlah yang lebih tinggi.

Pembuatan Larutan Penyangga Asam Materi Larutan Penyangga Kimia SMA Pojan.id YouTube
Contoh Kalimat Offering Help dan Responnya (Formal & Informal) Sifat Larutan Buffer Nah, diatas tadi sudah dijelaskan pengertian larutan buffer selanjutnya mari kita bahas sifat larutan penyangga atau buffer. Soalnya larutan itu sendiri dari awal sudah mengandung zat bersifat asam dan basa.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download ID6420439
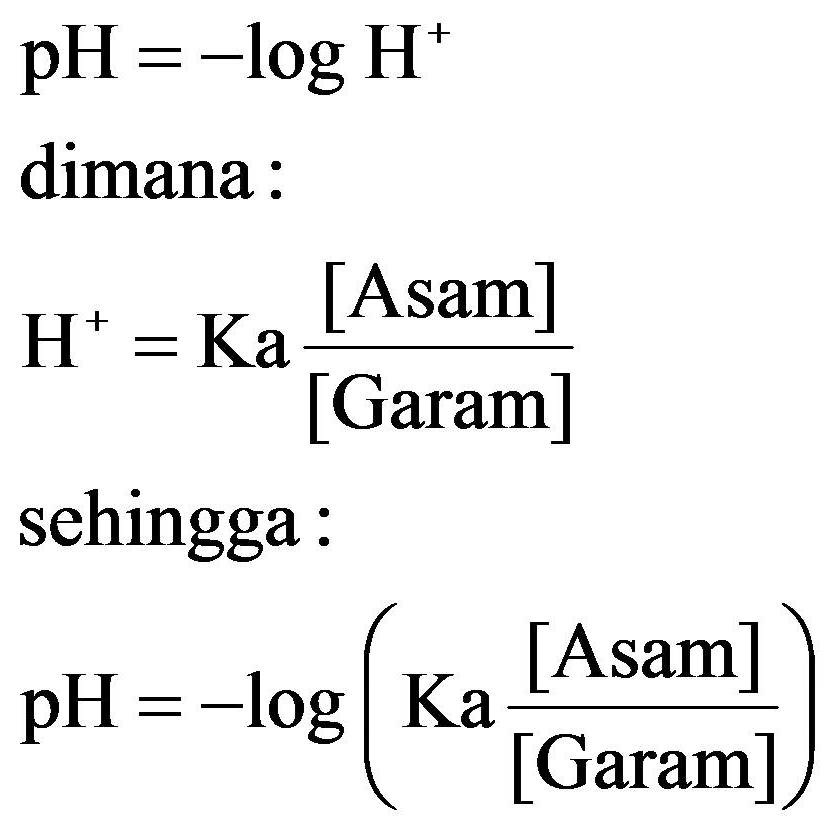
Ka = Konstanta asam; Kb = Konstanta basa; Contoh Soal Terkait Larutan Buffer. Untuk mendapatkan pemahaman yang lebih dalam, berikut ini adalah contoh soal terkait larutan buffer beserta penjelasan solusinya: 1. Contoh Soal 1. Jika 50 mL NH 3 0.1 M dicampur dengan 100 mL NH 4 Cl 0.5 M dengan Kb 10^-5, maka pH larutannya adalah… Penyelesaian:

Penyangga Buffer Asam Asetat dan Natrium Asetat YouTube
1. Larutan penyangga asam. Larutan penyangga asam merupakan larutan penyangga yang terdiri dari asam lemah dan basa konjugasinya. Larutan penyangga ini berfungsi untuk mempertahankan pH pada kondisi asam (pH < 7). Adapun contoh larutan penyangga asam adalah campuran antara CH 3 COOH dan CH 3 COONa.

Kekuatan asam basa, Buffer, dan Kesetimbangan YouTube
Contoh penerapannya adalah sebagai berikut : CH3COOH + NaCH3COO (dengan komposisi komponen buffernya adalah: CH3COOH dan CH3COO -) H2CO3 + NaHCO3 (dengan komposisi komponen buffernya adalah: H2CO3 dan HCO3 -) NaH2PO4 + Na2HPO4 (dengan komposisi komponen buffernya adalah: H2PO4 - dan HPO4 2-)

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
Larutan buffer menjadi salah satu produk yang dihasilkan dari reaksi asam dan basa. Larutan buffer terbentuk dari interaksi antara asam atau basa lemah dengan garamnya (konjugasinya). Jika Sobat Pijar ingin mengingat kembali tentang asam/basa konjugasi, hal tersebut dijelaskan dalam pengertian asam dan basa oleh Bronsted-Lowry.. Contoh lain.

30+ Contoh Soal Asam Basa Buffer Cherie Potts
Contoh Soal Tipe I Hitunglah pH 100 mL CH 3 COOK 0,5 M dengan 200 mL CH 3 COOH 0,5 M (Ka CH 3 COOH = 1,7 x 10 -5 ). Jawab : [H +] = 1,7 x 10 -5 x 2 = 3,4 x 10 -5 pH = 5 - log 3,4 Larutan Penyangga Basa Rumus Menentukan pH Terbentuk dari Basa lemah & Asam Konjugasinya (dari garamnya) Tipe Soal:

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download ID6420439
Penambahan basa (OH −): ion OH − dari asam yang ditambahkan akan bereaksi dengan komponen asam konjugasinya. Misal larutan buffer basa NH3 / NH + 4: NH3 + H + ⇄ NH + 4 NH + 4 + OH − → NH3 + H2O. -. pengenceran: pada pengenceran hanya memperbesar volume komponen-komponen larutan penyangga.